Artikel Pendidikan - Konsep Ikatan Kimia dan Penamaan Senyawa Kimia tentang struktur Lewis, ikatan ion, ikatan kovalen, ikatan kovalen koordinasi, ikatan logam, dan gaya antarmolekul.
Struktur Lewis
Struktur Lewis adalah struktur yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Struktur Lewis pada umumnya digunakan untuk menggambarkan ikatan kovalen dan ikatan kovalen koordinasi. Struktur lewis dapat menunjukkan adanya pasangan elektron yang tidak terlibat dalam ikatan dan muatan formal yang terjadi akibat pemakaian elektron dalam ikatan. Cara penulisan struktur Lewis seperti berikut.
1. Meletakkan satu unsur dengan elektronegativitas yang terendah sebagai pusatnya
2. Menghitung jumlah total elektron valensi (ditambah 1 elektron untuk muatan negatif dan dikurangi 1 elektron untuk muatan positif)
3. Melengkapai aturan oktet untuk semua atom kecuali H
4. Jika jumlah total elektron struktur lebih banayk dari jumlah total elektron valensi, buat ikatan rangkap pada pusat atom
5. Jika terdapat kelebihan elektron, tempatkan pada atom pusat
Contoh penulisan struktur Lewis untuk CH4:
Ikatan Ion dan Ikatan Kovalen
Ikatan kimia dapat terjadi antaratom atau antarmolekul dengan cara atom yang 1 melepaskan elektron, sedangkan atom yang lain menerima elektron, atau penggunaan bersama pasangan elektron yang berasal dari salah satu atom. Tujuan pembentukan ikatan kimia adalah agar terjadi pencapaian kestabilan suatu unsur.
Pada pembentukan ikatan kimia, elektron yang berperan adalah elektron valensi dari suatu atom atau unsur yang terlibat. Salah satu petunjuk dalam pembentukan ikatan kimia adalah adanya satu golongan unsur yang stabil, yaitu golongan VIIIA (gas mulia). Baca tentang : Ikatan Ion
Unsur gas mulia mempunyai elektron valensi sebanyak 8 (kaidah oktet) atau 2 (kaidah duplet, yaitu atom Helium). Oleh sebab itu, dalam pembentukan ikatan kimia, atom-atom akan membentuk konfigurasi elektron seperti pada unsur gas mulia. Kecenderungan unsur-unsur untuk menjadikan konfigurasi elektronnya sama seperti gas mulia terdekat dikenal dengan istilah Aturan Oktet yang diperkenalkan oleh W. Kossel dan G.N Lewis.
Unsur dengan elektron valensi bernilai kecil, yaitu 1, 2, dan 3 mempunyai kecenderungan melepaskan elektron membentuk ion positif atau kation (unsur logam). Pelepasan elektron tersebut untuk membentuk konfigurasi elektron seperti unsur gas mulia.
Struktur Lewis
Struktur Lewis adalah struktur yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Struktur Lewis pada umumnya digunakan untuk menggambarkan ikatan kovalen dan ikatan kovalen koordinasi. Struktur lewis dapat menunjukkan adanya pasangan elektron yang tidak terlibat dalam ikatan dan muatan formal yang terjadi akibat pemakaian elektron dalam ikatan. Cara penulisan struktur Lewis seperti berikut.
1. Meletakkan satu unsur dengan elektronegativitas yang terendah sebagai pusatnya
2. Menghitung jumlah total elektron valensi (ditambah 1 elektron untuk muatan negatif dan dikurangi 1 elektron untuk muatan positif)
3. Melengkapai aturan oktet untuk semua atom kecuali H
4. Jika jumlah total elektron struktur lebih banayk dari jumlah total elektron valensi, buat ikatan rangkap pada pusat atom
5. Jika terdapat kelebihan elektron, tempatkan pada atom pusat
Contoh penulisan struktur Lewis untuk CH4:
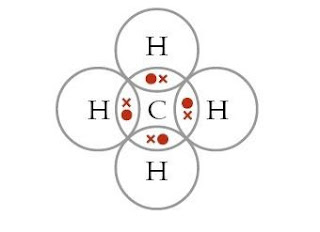 |
| Contoh Struktur Lewis |
Ikatan Ion dan Ikatan Kovalen
Ikatan kimia dapat terjadi antaratom atau antarmolekul dengan cara atom yang 1 melepaskan elektron, sedangkan atom yang lain menerima elektron, atau penggunaan bersama pasangan elektron yang berasal dari salah satu atom. Tujuan pembentukan ikatan kimia adalah agar terjadi pencapaian kestabilan suatu unsur.
Pada pembentukan ikatan kimia, elektron yang berperan adalah elektron valensi dari suatu atom atau unsur yang terlibat. Salah satu petunjuk dalam pembentukan ikatan kimia adalah adanya satu golongan unsur yang stabil, yaitu golongan VIIIA (gas mulia). Baca tentang : Ikatan Ion
Unsur gas mulia mempunyai elektron valensi sebanyak 8 (kaidah oktet) atau 2 (kaidah duplet, yaitu atom Helium). Oleh sebab itu, dalam pembentukan ikatan kimia, atom-atom akan membentuk konfigurasi elektron seperti pada unsur gas mulia. Kecenderungan unsur-unsur untuk menjadikan konfigurasi elektronnya sama seperti gas mulia terdekat dikenal dengan istilah Aturan Oktet yang diperkenalkan oleh W. Kossel dan G.N Lewis.
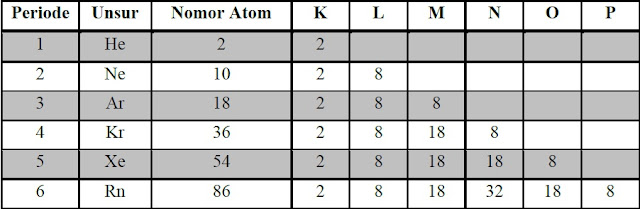 |
| Tabel Konfigurasi Elektron Gas Mulia |
