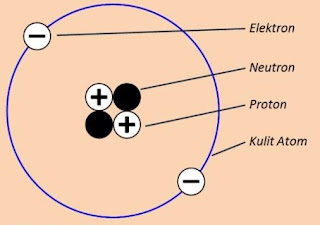
Artikel Pendidikan - Beberapa ahli membuat suatu model atom untuk menjelaskan bagaimana keadaan suatu atom yang sebenarnya berdasarkan fenomena yang ditimbulkannya. Model atom dapat dilihat pada gambar berikut.
Penyelidikan tentang atom dimulai dengan ditemukannya sifat listrik dari suatu materi. Bila sisir plastik digosokkan pada rambut yang tidak berminyak, sisir plastik tersebut akan dapat menarik potongan-potongan kecil kertas. Peristiwa itu menujukkan bahwa sisir mempunyai sifat listrik. Bila ditinjau lebih jauh, karena sisir merupakan materi sisir juga tersusun oleh atom-atom. Dengan demikian, dapat disimpulkan bahwa atom mempunyai sifat listrik. Gejala kelistrikan atom makin menarik para ahli fisika sehingga pada perkembangan selanjutnya, ditemukan bahwa atom tersusun atas partikel-partikel penyusun atom (partikel subatom) yang terdiri atas elektron, proton, dan neutron seperti terlihat pada gambar di atas.
1. Elektron
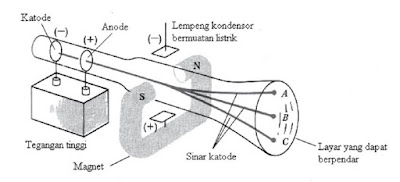
Bermula dengan ditemukannya tabung sinar katode oleh Karl Ferdinand Braun, yang terbuat dari tabung hampa dari kaca yang dialiri arus listrik searah dari kutub positif yang disebut anode dan dari kutub negatif yang disebut katode. Bila tabung tersebut dialiri arus listrik yang cukup kuat, akan terjadi aliran radiasi yang tidak tampak dari kutub negatif menuju kutub positif. Inilah yang disebut sinar katode. Sifat-sifat sinar katode dapat diketahui setelah penyempurnaan tabung sinar katode yang dilakukan oleh Sir William Crookes. Sifat-sifat sinar katode tersebut adalah sebagai berikut:
1. merambat menurut garis lurus
2. dapat memendarkan seng sulfida dan barium platinasianida
3. terdiri atas partikel bermuatan negatif (elektron)
4. dapat menimbulkan kalor pada benda-benda yang ditumbuknya
5. menghitamkan plat film
6. dapat menyimpang dalam medan magnet dan medan listrik
7. dapat menghasilkan sinar x ketika menumbuk zat
Setelah William Crookes menemukan tabung katode yang lebih baik pada tahun 1879, penelitian tentang sinar katode dilanjutkan oleh Joseph John Thomson. Penelitan tersebut mendapati bahwa sinar katode sebenarnya adalah materi yang ukurannya sangat kecil karena dapat memutar baling-baling yang dipasang di antara anode dan katode. Dari penelitiannya tersebut, J.J. Thomson dapat menentukan muatan elektron, yaitu sebesar 1,76 x 108 C/g.
Penyelidikan lebih lanjut mengenai elektron ini dilakukan oleh Robert A. Millikan antara tahun 1908–1917 yang dikenal dengan percobaan tetes minyak Millikan. Dari percobaan tersebut, Millikan berhasil menemukan muatan setiap tetes minyak, dimana muatan-muatan tersebut merupakan kelipatan dari bilangan yang sangat kecil, yaitu 1,6022 x 10-19 C. Berdasarkan percobaan Millikan, disimpulkan bahwa muatan 1
elektron adalah 1,6022 x 10-19 C. Dari harga muatan tersebut, dapat dihitung massa satu elektron:
Dari hasil percobaan tersebut, J.J Thomson berkesimpulan bahwa sinar katode merupakan partikel penyusun atom (partikel subatom) yang bermuatan negatif (-1,6022 x 10-19 C) dan mempunyai massa 9,10 x 10-28 gram, dan selanjutnya oleh Stoney diusulkan nama elektron. Dari penemuan tersebut, dapat disimpulkan bahwa elektron adalah partikel subatom yang bermuatan negatif dan umumnya ditulis sebagai e-.
2. Inti Atom dan Proton
Pusat dari atom disebut inti atom atau nukleus. Inti atom terdiri atas proton dan neutron. Banyaknya proton dalam inti atom disebut nomor atom yang menentukan elemen dari suatu atom. Penemuan elektron oleh Thomson menyebabkan para ahli makin yakin bahwa atom tersusun atas partikel-partikel subatom yang lebih kecil ukurannya. Pada tahun 1886, Eugene Goldstein memodifikasi tabung sinar katode dengan melubangi lempeng katodenya. Dari percobaan tersebut, ditemukan sinar yang arahnya berlawanan dengan sinar katode. Sinar tersebut menembus lubang katode yang telah dibuat dan disebut sinar kanal (karena menembus lubang kanal pada katode). Pada tahun 1898, Wilhelm Wien menunjukkan bahwa sinar kanal merupakan partikel yang bermuatan positif dan selanjutnya disebut dengan proton. Sifat proton bergantung pada gas yang diisikan pada tabung katode. Dari penelitiannya terhadap atom hidrogen, dapat ditentukan bahwa massa proton adalah 1.837 kali massa elektron.
Penemuan proton ini menimbulkan banyak pertanyaan. Bagaimanakah kedudukan setiap partikel tersebut di dalam atom? Untuk mengetahui kedudukan partikel-partikel tersebut, Ernest Rutherford bersama asistennya, Hans Geiger dan Ernest Marsden melakukan percobaan hamburan sinar alfa terhadap lempeng tipis emas. Pada percobaan sinar alfa Rutherford, sinar alfa yang bermuatan positif terpental jauh ketika menuju ke pusat atom. Pada daerah lain, jalur partikel alfa hampir tidak berubah. Kesimpulannya, ada partikel besar bermuatan positif di tengah-tengah atom.
Dengan penelitian yang lebih lanjut, model atom Rutherford pun disempurnakan. Inti atom diketahui dengan pasti susunannya. Ada muatan positif yang dinamakan proton dan juga partikel bermuatan netral yang dinamakan neutron. Adapun ide tentang elektron tidak berubah, elektron tetap digambarkan mengelilingi inti atom menurut orbit.
3. Neutron
Neutron atau netron adalah partikel subatomik yang tidak bermuatan (netral) dan memiliki massa 940 MeV/C² (1.6749 × 10−27 kg, sedikit lebih berat dari proton. Inti atom dari kebanyakan atom (semua kecuali isotop hidrogen yang paling umum, yang terdiri atas sebuah proton) terdiri atas proton dan neutron.
Di luar inti atom, neutron tidak stabil dan memiliki waktu paruh sekitar 15 menit (881.5±1.5 detik). Metode peluruhan yang sama (peluruhan beta) terjadi di beberapa inti atom. Partikel-partikel dalam inti atom biasanya adalah neutron dan proton. Perbedaan utama dari neutron dengan partikel subatomik lainnya adalah mereka tidak bermuatan. Sifat neutron ini membuat penemuannya lebih terbelakang dan membuatnya sulit diamati secara langsung.
Penelitian yang dilakukan Rutherford selain sukses mendapatkan beberapa hasil yang memuaskan juga mendapatkan kejanggalan, yaitu massa inti atom unsur selalu lebih besar daripada massa proton di dalam inti atom. Rutherford menduga bahwa terdapat partikel lain di dalam inti atom yang tidak bermuatan karena atom bermuatan positif. Adanya partikel lain di dalam inti atom yang tidak bermuatan dibuktikan oleh James Chadwick pada tahun 1932. Chadwick melakukan penelitian dengan menembak logam berilium menggunakan sinar alfa. Hasil penelitian menunjukkan bahwa suatu partikel yang tak bermuatan dilepaskan ketika logam berilium ditembak dengan sinar alfa dan partikel ini disebut sebagai neutron.
C. Tanda Atom
Proton merupakan partikel khas suatu atom. Artinya, tiap atom akan mempunyai jumlah proton yang berbeda dengan atom lain. Hal ini didukung dengan fakta percobaan yang dilakukan oleh Henry Moseley. Pada saat itu, sinar X sudah banyak dimanfaatkan untuk rontgen dan umumnya dibuat dengan cara membombardir logam dengan menggunakan elektron. Dari pengamatan Moseley, ternyata sinar X yang dihasilkan mempunyai frekuensi yang dipengaruhi oleh jumlah proton logam yang ditembak. Berdasarkan inilah, kemudian disimpulkan bahwa jumlah proton merupakan sifat khas dari suatu atom.
Bila atom-atom diurutkan berdasarkan jumlah protonnya, atom hidrogen akan mempunyai nomor satu karena mempunyai sebuah proton, helium nomor dua karena mempunyai dua proton, dan seterusnya. Selanjutnya, jumlah proton yang terdapat dalam inti atom disebut nomor atom (Z). Nomor atom suatu unsur adalah khas, artinya nomor tersebut hanya dimiliki oleh atom bersangkutan. Sebagai contoh, jika nomor atomnya 6 berarti atom tersebut mempunyai jumlah proton 6, dan satu-satunya atom yang mempunyai jumlah proton 6 hanya atom karbon. Sebaliknya, apabila disebut unsur karbon, atomnya mempunyai proton sebanyak 6 karena tidak ada atom lain selain karbon yang mempunyai jumlah proton 6.
Massa atom merupakan massa dari seluruh partikel penyusun atom. Karena sangat kecil, massa elektron dapat diabaikan sehingga massa atom dianggap merupakan jumlah massa proton dan neutron saja. Jumlah proton dan neutron selanjutnya disebut nomor massa (A) dari suatu atom. Kecuali hidrogen, semua atom mempunyai neutron sehingga secara umum:
Keterangan:
X = lambang unsur
A = nomor massa
Z = nomor atom
Atom-atom suatu unsur dapat mempunyai nomor massa yang berbeda karena jumlah neutron dalam atom tersebut berbeda. Sebagai contoh, hidrogen mempunyai tiga jenis atom, yaitu atom hidrogen yang hanya mempunyai sebuah proton di dalam inti tanpa ada neutronnya, atom hidrogen yang mempunyai sebuah neutron, dan atom hidrogen dengan dua buah neutron sehingga atom hidrogen ada yang mempunyai nomor massa 1 satuan massa atom (sma), 2 sma, dan 3 sma. Atom-atom dari unsur yang sama tetapi mempunyai nomor massa yang berbeda disebut isotop.
Untuk membedakan isotop yang satu dan isotop lainnya, digunakan tanda atom lengkap yang menunjukkan jumlah proton dan neutron atau nomor atom dan nomor massa. Atom-atom unsur yang berbeda dapat dipastikan mempunyai jumlah proton yang berbeda tetapi dapat mempunyai nomor massa yang sama. Peristiwa ini disebut isobar. Atom yang mempunyai jumlah proton yang berbeda tetapi jumlah neutronnya sama disebut isoton.
Penyelidikan tentang atom dimulai dengan ditemukannya sifat listrik dari suatu materi. Bila sisir plastik digosokkan pada rambut yang tidak berminyak, sisir plastik tersebut akan dapat menarik potongan-potongan kecil kertas. Peristiwa itu menujukkan bahwa sisir mempunyai sifat listrik. Bila ditinjau lebih jauh, karena sisir merupakan materi sisir juga tersusun oleh atom-atom. Dengan demikian, dapat disimpulkan bahwa atom mempunyai sifat listrik. Gejala kelistrikan atom makin menarik para ahli fisika sehingga pada perkembangan selanjutnya, ditemukan bahwa atom tersusun atas partikel-partikel penyusun atom (partikel subatom) yang terdiri atas elektron, proton, dan neutron seperti terlihat pada gambar di atas.
1. Elektron
Bermula dengan ditemukannya tabung sinar katode oleh Karl Ferdinand Braun, yang terbuat dari tabung hampa dari kaca yang dialiri arus listrik searah dari kutub positif yang disebut anode dan dari kutub negatif yang disebut katode. Bila tabung tersebut dialiri arus listrik yang cukup kuat, akan terjadi aliran radiasi yang tidak tampak dari kutub negatif menuju kutub positif. Inilah yang disebut sinar katode. Sifat-sifat sinar katode dapat diketahui setelah penyempurnaan tabung sinar katode yang dilakukan oleh Sir William Crookes. Sifat-sifat sinar katode tersebut adalah sebagai berikut:
1. merambat menurut garis lurus
2. dapat memendarkan seng sulfida dan barium platinasianida
3. terdiri atas partikel bermuatan negatif (elektron)
4. dapat menimbulkan kalor pada benda-benda yang ditumbuknya
5. menghitamkan plat film
6. dapat menyimpang dalam medan magnet dan medan listrik
7. dapat menghasilkan sinar x ketika menumbuk zat
Setelah William Crookes menemukan tabung katode yang lebih baik pada tahun 1879, penelitian tentang sinar katode dilanjutkan oleh Joseph John Thomson. Penelitan tersebut mendapati bahwa sinar katode sebenarnya adalah materi yang ukurannya sangat kecil karena dapat memutar baling-baling yang dipasang di antara anode dan katode. Dari penelitiannya tersebut, J.J. Thomson dapat menentukan muatan elektron, yaitu sebesar 1,76 x 108 C/g.
Penyelidikan lebih lanjut mengenai elektron ini dilakukan oleh Robert A. Millikan antara tahun 1908–1917 yang dikenal dengan percobaan tetes minyak Millikan. Dari percobaan tersebut, Millikan berhasil menemukan muatan setiap tetes minyak, dimana muatan-muatan tersebut merupakan kelipatan dari bilangan yang sangat kecil, yaitu 1,6022 x 10-19 C. Berdasarkan percobaan Millikan, disimpulkan bahwa muatan 1
elektron adalah 1,6022 x 10-19 C. Dari harga muatan tersebut, dapat dihitung massa satu elektron:
Dari hasil percobaan tersebut, J.J Thomson berkesimpulan bahwa sinar katode merupakan partikel penyusun atom (partikel subatom) yang bermuatan negatif (-1,6022 x 10-19 C) dan mempunyai massa 9,10 x 10-28 gram, dan selanjutnya oleh Stoney diusulkan nama elektron. Dari penemuan tersebut, dapat disimpulkan bahwa elektron adalah partikel subatom yang bermuatan negatif dan umumnya ditulis sebagai e-.
2. Inti Atom dan Proton
Pusat dari atom disebut inti atom atau nukleus. Inti atom terdiri atas proton dan neutron. Banyaknya proton dalam inti atom disebut nomor atom yang menentukan elemen dari suatu atom. Penemuan elektron oleh Thomson menyebabkan para ahli makin yakin bahwa atom tersusun atas partikel-partikel subatom yang lebih kecil ukurannya. Pada tahun 1886, Eugene Goldstein memodifikasi tabung sinar katode dengan melubangi lempeng katodenya. Dari percobaan tersebut, ditemukan sinar yang arahnya berlawanan dengan sinar katode. Sinar tersebut menembus lubang katode yang telah dibuat dan disebut sinar kanal (karena menembus lubang kanal pada katode). Pada tahun 1898, Wilhelm Wien menunjukkan bahwa sinar kanal merupakan partikel yang bermuatan positif dan selanjutnya disebut dengan proton. Sifat proton bergantung pada gas yang diisikan pada tabung katode. Dari penelitiannya terhadap atom hidrogen, dapat ditentukan bahwa massa proton adalah 1.837 kali massa elektron.
Penemuan proton ini menimbulkan banyak pertanyaan. Bagaimanakah kedudukan setiap partikel tersebut di dalam atom? Untuk mengetahui kedudukan partikel-partikel tersebut, Ernest Rutherford bersama asistennya, Hans Geiger dan Ernest Marsden melakukan percobaan hamburan sinar alfa terhadap lempeng tipis emas. Pada percobaan sinar alfa Rutherford, sinar alfa yang bermuatan positif terpental jauh ketika menuju ke pusat atom. Pada daerah lain, jalur partikel alfa hampir tidak berubah. Kesimpulannya, ada partikel besar bermuatan positif di tengah-tengah atom.
Dengan penelitian yang lebih lanjut, model atom Rutherford pun disempurnakan. Inti atom diketahui dengan pasti susunannya. Ada muatan positif yang dinamakan proton dan juga partikel bermuatan netral yang dinamakan neutron. Adapun ide tentang elektron tidak berubah, elektron tetap digambarkan mengelilingi inti atom menurut orbit.
3. Neutron
Neutron atau netron adalah partikel subatomik yang tidak bermuatan (netral) dan memiliki massa 940 MeV/C² (1.6749 × 10−27 kg, sedikit lebih berat dari proton. Inti atom dari kebanyakan atom (semua kecuali isotop hidrogen yang paling umum, yang terdiri atas sebuah proton) terdiri atas proton dan neutron.
Di luar inti atom, neutron tidak stabil dan memiliki waktu paruh sekitar 15 menit (881.5±1.5 detik). Metode peluruhan yang sama (peluruhan beta) terjadi di beberapa inti atom. Partikel-partikel dalam inti atom biasanya adalah neutron dan proton. Perbedaan utama dari neutron dengan partikel subatomik lainnya adalah mereka tidak bermuatan. Sifat neutron ini membuat penemuannya lebih terbelakang dan membuatnya sulit diamati secara langsung.
Penelitian yang dilakukan Rutherford selain sukses mendapatkan beberapa hasil yang memuaskan juga mendapatkan kejanggalan, yaitu massa inti atom unsur selalu lebih besar daripada massa proton di dalam inti atom. Rutherford menduga bahwa terdapat partikel lain di dalam inti atom yang tidak bermuatan karena atom bermuatan positif. Adanya partikel lain di dalam inti atom yang tidak bermuatan dibuktikan oleh James Chadwick pada tahun 1932. Chadwick melakukan penelitian dengan menembak logam berilium menggunakan sinar alfa. Hasil penelitian menunjukkan bahwa suatu partikel yang tak bermuatan dilepaskan ketika logam berilium ditembak dengan sinar alfa dan partikel ini disebut sebagai neutron.
C. Tanda Atom
Proton merupakan partikel khas suatu atom. Artinya, tiap atom akan mempunyai jumlah proton yang berbeda dengan atom lain. Hal ini didukung dengan fakta percobaan yang dilakukan oleh Henry Moseley. Pada saat itu, sinar X sudah banyak dimanfaatkan untuk rontgen dan umumnya dibuat dengan cara membombardir logam dengan menggunakan elektron. Dari pengamatan Moseley, ternyata sinar X yang dihasilkan mempunyai frekuensi yang dipengaruhi oleh jumlah proton logam yang ditembak. Berdasarkan inilah, kemudian disimpulkan bahwa jumlah proton merupakan sifat khas dari suatu atom.
Bila atom-atom diurutkan berdasarkan jumlah protonnya, atom hidrogen akan mempunyai nomor satu karena mempunyai sebuah proton, helium nomor dua karena mempunyai dua proton, dan seterusnya. Selanjutnya, jumlah proton yang terdapat dalam inti atom disebut nomor atom (Z). Nomor atom suatu unsur adalah khas, artinya nomor tersebut hanya dimiliki oleh atom bersangkutan. Sebagai contoh, jika nomor atomnya 6 berarti atom tersebut mempunyai jumlah proton 6, dan satu-satunya atom yang mempunyai jumlah proton 6 hanya atom karbon. Sebaliknya, apabila disebut unsur karbon, atomnya mempunyai proton sebanyak 6 karena tidak ada atom lain selain karbon yang mempunyai jumlah proton 6.
Massa atom merupakan massa dari seluruh partikel penyusun atom. Karena sangat kecil, massa elektron dapat diabaikan sehingga massa atom dianggap merupakan jumlah massa proton dan neutron saja. Jumlah proton dan neutron selanjutnya disebut nomor massa (A) dari suatu atom. Kecuali hidrogen, semua atom mempunyai neutron sehingga secara umum:
Keterangan:
X = lambang unsur
A = nomor massa
Z = nomor atom
Atom-atom suatu unsur dapat mempunyai nomor massa yang berbeda karena jumlah neutron dalam atom tersebut berbeda. Sebagai contoh, hidrogen mempunyai tiga jenis atom, yaitu atom hidrogen yang hanya mempunyai sebuah proton di dalam inti tanpa ada neutronnya, atom hidrogen yang mempunyai sebuah neutron, dan atom hidrogen dengan dua buah neutron sehingga atom hidrogen ada yang mempunyai nomor massa 1 satuan massa atom (sma), 2 sma, dan 3 sma. Atom-atom dari unsur yang sama tetapi mempunyai nomor massa yang berbeda disebut isotop.
 |
| Sumber : sridianti.com |
Untuk membedakan isotop yang satu dan isotop lainnya, digunakan tanda atom lengkap yang menunjukkan jumlah proton dan neutron atau nomor atom dan nomor massa. Atom-atom unsur yang berbeda dapat dipastikan mempunyai jumlah proton yang berbeda tetapi dapat mempunyai nomor massa yang sama. Peristiwa ini disebut isobar. Atom yang mempunyai jumlah proton yang berbeda tetapi jumlah neutronnya sama disebut isoton.