Artikel Pendidikan - Pada tahun 1661, masih banyak ahli yang berpendapat bahwa unsur merupakan suatu zat tidak mungkin dapat diuraikan. Pada saat itu, baru dikenal beberapa unsur, yaitu antimen, arsen, bismut, karbon, tembaga, emas, timbal, air raksa, perak, belerang, timah, dan seng. Pada akhir abad ke-18, baru ditemukan 11 unsur baru yang dipublikasikan oleh Lavoisier, yaitu klorin, kobalt, hidrogen, mangan, molibdat, nikel, nitrogen, oksigen, fosfor, platina, dan wolfram. Setelah itu, terus ditemukan dua sampai tiga unsur setiap tahun sehingga sampai saat ini, sudah dikenal 118 macam unsur.
Untuk mempelajari unsur-unsur yang begitu banyak, diperlukan suatu cara agar mudah untuk mengenali sifat-sifatnya. Sistem periodik unsur merupakan suatu sustem yang sangat baik untuk mempelajari kecenderungan sifat unsur dan beberapa sifat yang lainnya. Bahkan, dapat digunakan untuk meramalkan sifat-sifat unsur yang belum ditemukan, tetapi diyakini ada.
Sistem periodik adalah suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya. Robert Boyle adalah orang pertama yang memberikan tentang definisi bahwa unsur adalah suatu zat yang tidak dapat lagi dibagi-bagi menjadi dua zat atau lebih dengan cara kimia. Sejak itu, orang dapat menyimpulkan bahwa unsur-unsur mempunyai sifat yang jelas dan ada kemiripan di antara sifat-sifat unsur itu.
1. Pengelompokan Unsur menurut Antoine Lavoisier
Setelah Boyle memberi penjelasan tentang konsep unsur, Lavoiser pada tahun 1769 menerbitkan suatu daftar unsur-unsur. Lavoiser membagi unsur-unsur dalam unsur logam dan nonlogam. Pada waktu itu, baru dikenal kurang lebih 33 unsur. Pengelompokan ini merupakan metode paling sederhana karena antara unsur-unsur logam sendiri masih banyak perbedaan. Ternyata, selain unsur logam dan nonlogam, masih ditemukan beberapa unsur yang memiliki sifat logam dan nonlogam (unsur metaloid), misalnya unsur silikon, antimon, dan arsen. Jadi, penggolongan unsur menjadi unsur logam dan nonlogam masih memiliki kelemahan.
Pengelompokan ini mempunyai kelebihan, yaitu sudah mengelompokkan 33 unsur berdasarkan sifat kima sehingga bisa dijadikan referensi bagi ilmuwan setelahnya. Kelemahannya ialah pengelompokannya masih terlalu umum.
2. Pengelompokan Unsur menurut Johann Wolfgang Dobereiner
Dobereiner adalah orang pertama yang menemukan hubungan antara sifat unsur dan massa atom relatifnya. Unsur-unsur dikelompokkan berdasarkan kemiripan sifat-sifatnya. Setiap kelompok terdiri atas tiga unsur sehingga disebut triade. Di dalam triade, unsur ke-2 mempunyai sifat-sifat yang berada di antara unsur ke-1 dan ke-3 dan memiliki massa atom sama dengan massa rata-rata unsur ke-1 dan ke-3. Ketiga jenis triade adalah:
(1) Triade Litium(Li), Natrium(Na), Kalium(K); (2) Triade Kalsium(Ca), Stronsium(Sr), Barium(Br); dan (3) Triade Klor(Cl), Brom(Br), Iodium(I).
Pengelompokan ini mempunyai kelebihan, yaitu keteraturan setiap unsur yang sifatnya mirip massa atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsur pertama dan ketiga. Kelemahannya ialah kurang efisien karena ada beberapa unsur lain yang tidak termasuk dalam kelompok triade padahal sifatnya sama dengan unsur di dalam kelompok triade tersebut.
3. Pengelompokan Unsur menurut John Newlands
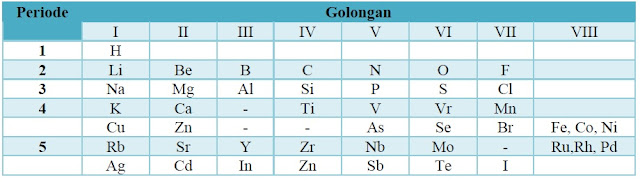
Triade Debereiner mendorong John Alexander Reina Newlands untuk melanjutkan upaya pengelompokan unsur-unsur berdasarkan kenaikan massa atom dan keterkaitannya dengan sifat unsur. Menurut Newlands, jika unsur-unsur diurutkan letaknya sesuai dengan kenaikan massa atom relatifnya, maka sifat unsur akan terulang pada tiap unsur kedelapan. Keteraturan ini sesuai dengan pengulangan not lagu (oktaf) sehingga disebut Hukum Oktaf (law of octaves). Gambar berikut menunjukkan pengelompokan unsur berdasarkan hukum Oktaf Newlands.
Namun, pada kenyataannya, masih ditemukan beberapa oktaf yang isinya lebih dari delapan unsur. Penggolongan ini tidak cocok untuk unsur yang massa atomnya sangat besar. Hal ini merupakan kekurangan dari metode ini.
4. Pengelompokan Unsur menurut Dmitri Mendeleev
Dmitri Ivanovich Mendeleev pada tahun 1869 melakukan pengamatan 63 unsur yang sudah dikenal dan mendapatkan hasil bahwa sifat unsur merupakan fungsi periodik dari massa atom relatifnya. Sifat tertentu akan berulang secara periodik apabila unsur-unsur disusun berdasarkan kenaikan massa atom relatifnya. Mendeleev selanjutnya menempatkan unsur-unsur dengan kemiripan sifat pada satu lajur vertikal yang disebut golongan. Unsur-unsur juga disusun berdasarkan kenaikan massa atom relatifnya dan ditempatkan dalam satu lajur yang disebut periode.
Pengelompokan ini mempunyai kelebihan, yaitu sistem Periodik Mendeleev menyediakan beberapa tempat kosong untuk unsur-unsur yang belum ditemukan dan dapat meramalkan sifat-sifat unsur yang belum diketahui. Pada perkembangan selanjutnya, beberapa unsur yang ditemukan ternyata cocok dengan prediksi Mendeleev. Kelemahannya yaitu terdapat unsur bermassa lebih besar yang letaknya di depan unsur bermassa lebih kecil, adanya unsur-unsur yang tidak mempunyai kesamaan sifat dimasukkan ke dalam satu golongan, misalnya Cu dan Ag ditempatkan dengan unsur Li, Na, K, Rb dan Cs serta adanya penempatan unsur-unsur yang tidak sesuai dengan kenaikan massa atom.
5. Pengelompokan Unsur menurut Henry Moseley
Tabel periodik Mendeleev dikemukakan sebelum penemuan struktur atom, yaitu partikel-partikel penyusun atom. Partikel penyusun inti atom yaitu proton dan neutron, sedangkan elektron mengitari inti atom. Setelah partikel-partikel penyusun atom ditemukan, ternyata ada beberapa unsur yang mempunyai jumlah partikel proton atau elektron sama, tetapi jumlah neutron berbeda. Unsur tersebut dikenal sebagai isotop. Jadi, terdapat atom yang mempunyai jumlah proton dan sifat kimia sama, tetapi massanya berbeda karena massa proton dan neutron menentukan massa atom.
Dengan demikian, sifat kimia tidak ditentukan oleh massa atom, tetapi ditentukan oleh jumlah proton dalam atom tersebut. Jumlah proton menyatakan nomor atom. Dengan demikian sifat-sifat unsur ditentukan oleh nomor atom. Keperiodikan sifat fisika dan kimia unsur disusun berdasarkan nomor atomnya. Pernyataan tersebut disimpulkan berdasarkan hasil percobaan Henry Moseley pada tahun 1913. Menurut Moseley, sifat-sifat kimia unsur merupakan fungsi periodik dari nomor atomnya. Artinya, jika unsur-unsur diurutkan berdasarkan kenaikan nomor atomnya, maka sifat-sifat unsur akan berulang secara periodik.
Susunan periodik yang disusun oleh Moseley akhirnya berkembang lebih baik sampai didapatkan bentuk yang sekarang ini dengan mengikuti hukum periodik bahwa bila unsur disusun berdasarkan kenaikan nomor atom, maka sifat unsur akan berulang secara periodik. Sistem periodik modern dikenal juga sebagai sistem periodik bentuk panjang, terdapat lajur mendatar yang disebut periode dan lajur tegak yang disebut golongan.
Dalam sistem periodik modern terdapat 7 periode, yaitu:
Periode 1 : terdiri atas 2 unsur
Periode 2 : terdiri atas 8 unsur
Periode 3 : terdiri atas 8 unsur
Periode 4 : terdiri atas 18 unsur
Periode 5 : terdiri atas 18 unsur
Periode 6 : terdiri atas 32 unsur, yaitu 18 unsur seperti periode 4 atau 5, dan 14 unsur lagi merupakan deret lantanida
Periode 7 : merupakan periode unsur yang belum lengkap. Pada periode ini terdapat deret aktinida
6. Hubungan Konfigurasi Elektron dan Sistem Periodik Unsur
Konfigurasi elektron sangat erat hubungannya dengan sistem periodik unsur. Seperti telah Anda ketahui, bahwa sifat-sifat unsur sangat bergantung pada jumlah elektron valensinya. Jika jumlah elektron luar yang mengisi orbital dalam subkulit sama dengan bilangan kuantum utama (n), atom unsur tersebut pasti terletak pada golongan yang sama (selain yang berbentuk ion). Adapun nilai n (bilangan kuantum utama) yang terbesar menunjuk nomor periode unsur tersebut dalam sistem periodik unsur. Misal, konfigurasi elektron unsur K sebagai berikut.
19K : 1s2 2s2 2p6 3s2 3p6 4s1.
Nilai n terbesar adalah 4. Jadi, K menempati periode 4.
Untuk menentukan golongan unsur dalam sistem periodik berdasarkan konfigurasi elektron, perlu dilihat jenis dan jumlah elektron terluar yang menempati kulit yang sama.
a. Golongan utama (Gol. A), elektron valensi menempati subkulit s atau subkulit s dan p.
b. Golongan transisi (Gol. B), elektron valensi menempati subkulit s dan d.
Untuk lantanida dan aktinida, elektron valensi menempati subkulit s dan f, tetapi jumlahnya tidak menentukan golongan karena lantanida dan aktinida tidak mempunyai golongan.
7. Pembagian Unsur-Unsur menurut Blok s , p, d, dan f
Berdasarkan kesamaan konfigurasi elektron terluar, dapat dikelompokkan unsur-unsur tersebut dalam blok berikut.
a. Blok s
Unsur yang mempunyai konfigurasi elektron terluar pada orbital s terletak pada golongan IA dan IIA, kecuali unsur H dan He. Unsur-unsur ini merupakan logam yang reaktif. Misal, konfigurasi elektron terluar adalah nsx. Maka, unsur tersebut terletak pada golongan xA.
b. Blok p
Unsur yang mempunyai konfigurasi elektron terluar pada orbital p terdapat dalam golongan IIIA, IVA, VA, VIA, VIIA, dan VIII. Golongan unsur-unsur ini meliputi logam, metaloid, dan non logam. Misal, konfigurasi elektron terluar adalah npy. Maka, unsur tersebut terletak pada golongan (2 + y)A.
c. Blok d
Konfigurasi elektron terluar d terdapat dalam unsur-unsur transisi, yaitu golongan IIIB, IVB, VB, VIB, VIIB, VIIIB, IB, dan IIB.
Jika:
a. x + z = 8, x + z = 9, dan x + z = 10, unsur terletak pada golongan VIIIB
b. x + z = 11, unsur terletak pada golongan IB
c. x + z = 12, unsur terletak pada golongan IIB
d. Blok f
Blok f merupakan golongan unsur lantanida dan aktinida. Golongan ini disebut juga golongan transisi dalam.
Untuk mempelajari unsur-unsur yang begitu banyak, diperlukan suatu cara agar mudah untuk mengenali sifat-sifatnya. Sistem periodik unsur merupakan suatu sustem yang sangat baik untuk mempelajari kecenderungan sifat unsur dan beberapa sifat yang lainnya. Bahkan, dapat digunakan untuk meramalkan sifat-sifat unsur yang belum ditemukan, tetapi diyakini ada.
Sistem periodik adalah suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya. Robert Boyle adalah orang pertama yang memberikan tentang definisi bahwa unsur adalah suatu zat yang tidak dapat lagi dibagi-bagi menjadi dua zat atau lebih dengan cara kimia. Sejak itu, orang dapat menyimpulkan bahwa unsur-unsur mempunyai sifat yang jelas dan ada kemiripan di antara sifat-sifat unsur itu.
1. Pengelompokan Unsur menurut Antoine Lavoisier
Setelah Boyle memberi penjelasan tentang konsep unsur, Lavoiser pada tahun 1769 menerbitkan suatu daftar unsur-unsur. Lavoiser membagi unsur-unsur dalam unsur logam dan nonlogam. Pada waktu itu, baru dikenal kurang lebih 33 unsur. Pengelompokan ini merupakan metode paling sederhana karena antara unsur-unsur logam sendiri masih banyak perbedaan. Ternyata, selain unsur logam dan nonlogam, masih ditemukan beberapa unsur yang memiliki sifat logam dan nonlogam (unsur metaloid), misalnya unsur silikon, antimon, dan arsen. Jadi, penggolongan unsur menjadi unsur logam dan nonlogam masih memiliki kelemahan.
Pengelompokan ini mempunyai kelebihan, yaitu sudah mengelompokkan 33 unsur berdasarkan sifat kima sehingga bisa dijadikan referensi bagi ilmuwan setelahnya. Kelemahannya ialah pengelompokannya masih terlalu umum.
2. Pengelompokan Unsur menurut Johann Wolfgang Dobereiner
Dobereiner adalah orang pertama yang menemukan hubungan antara sifat unsur dan massa atom relatifnya. Unsur-unsur dikelompokkan berdasarkan kemiripan sifat-sifatnya. Setiap kelompok terdiri atas tiga unsur sehingga disebut triade. Di dalam triade, unsur ke-2 mempunyai sifat-sifat yang berada di antara unsur ke-1 dan ke-3 dan memiliki massa atom sama dengan massa rata-rata unsur ke-1 dan ke-3. Ketiga jenis triade adalah:
(1) Triade Litium(Li), Natrium(Na), Kalium(K); (2) Triade Kalsium(Ca), Stronsium(Sr), Barium(Br); dan (3) Triade Klor(Cl), Brom(Br), Iodium(I).
Pengelompokan ini mempunyai kelebihan, yaitu keteraturan setiap unsur yang sifatnya mirip massa atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsur pertama dan ketiga. Kelemahannya ialah kurang efisien karena ada beberapa unsur lain yang tidak termasuk dalam kelompok triade padahal sifatnya sama dengan unsur di dalam kelompok triade tersebut.
3. Pengelompokan Unsur menurut John Newlands
Triade Debereiner mendorong John Alexander Reina Newlands untuk melanjutkan upaya pengelompokan unsur-unsur berdasarkan kenaikan massa atom dan keterkaitannya dengan sifat unsur. Menurut Newlands, jika unsur-unsur diurutkan letaknya sesuai dengan kenaikan massa atom relatifnya, maka sifat unsur akan terulang pada tiap unsur kedelapan. Keteraturan ini sesuai dengan pengulangan not lagu (oktaf) sehingga disebut Hukum Oktaf (law of octaves). Gambar berikut menunjukkan pengelompokan unsur berdasarkan hukum Oktaf Newlands.
Namun, pada kenyataannya, masih ditemukan beberapa oktaf yang isinya lebih dari delapan unsur. Penggolongan ini tidak cocok untuk unsur yang massa atomnya sangat besar. Hal ini merupakan kekurangan dari metode ini.
4. Pengelompokan Unsur menurut Dmitri Mendeleev
Dmitri Ivanovich Mendeleev pada tahun 1869 melakukan pengamatan 63 unsur yang sudah dikenal dan mendapatkan hasil bahwa sifat unsur merupakan fungsi periodik dari massa atom relatifnya. Sifat tertentu akan berulang secara periodik apabila unsur-unsur disusun berdasarkan kenaikan massa atom relatifnya. Mendeleev selanjutnya menempatkan unsur-unsur dengan kemiripan sifat pada satu lajur vertikal yang disebut golongan. Unsur-unsur juga disusun berdasarkan kenaikan massa atom relatifnya dan ditempatkan dalam satu lajur yang disebut periode.
Pengelompokan ini mempunyai kelebihan, yaitu sistem Periodik Mendeleev menyediakan beberapa tempat kosong untuk unsur-unsur yang belum ditemukan dan dapat meramalkan sifat-sifat unsur yang belum diketahui. Pada perkembangan selanjutnya, beberapa unsur yang ditemukan ternyata cocok dengan prediksi Mendeleev. Kelemahannya yaitu terdapat unsur bermassa lebih besar yang letaknya di depan unsur bermassa lebih kecil, adanya unsur-unsur yang tidak mempunyai kesamaan sifat dimasukkan ke dalam satu golongan, misalnya Cu dan Ag ditempatkan dengan unsur Li, Na, K, Rb dan Cs serta adanya penempatan unsur-unsur yang tidak sesuai dengan kenaikan massa atom.
5. Pengelompokan Unsur menurut Henry Moseley
Tabel periodik Mendeleev dikemukakan sebelum penemuan struktur atom, yaitu partikel-partikel penyusun atom. Partikel penyusun inti atom yaitu proton dan neutron, sedangkan elektron mengitari inti atom. Setelah partikel-partikel penyusun atom ditemukan, ternyata ada beberapa unsur yang mempunyai jumlah partikel proton atau elektron sama, tetapi jumlah neutron berbeda. Unsur tersebut dikenal sebagai isotop. Jadi, terdapat atom yang mempunyai jumlah proton dan sifat kimia sama, tetapi massanya berbeda karena massa proton dan neutron menentukan massa atom.
Dengan demikian, sifat kimia tidak ditentukan oleh massa atom, tetapi ditentukan oleh jumlah proton dalam atom tersebut. Jumlah proton menyatakan nomor atom. Dengan demikian sifat-sifat unsur ditentukan oleh nomor atom. Keperiodikan sifat fisika dan kimia unsur disusun berdasarkan nomor atomnya. Pernyataan tersebut disimpulkan berdasarkan hasil percobaan Henry Moseley pada tahun 1913. Menurut Moseley, sifat-sifat kimia unsur merupakan fungsi periodik dari nomor atomnya. Artinya, jika unsur-unsur diurutkan berdasarkan kenaikan nomor atomnya, maka sifat-sifat unsur akan berulang secara periodik.
Susunan periodik yang disusun oleh Moseley akhirnya berkembang lebih baik sampai didapatkan bentuk yang sekarang ini dengan mengikuti hukum periodik bahwa bila unsur disusun berdasarkan kenaikan nomor atom, maka sifat unsur akan berulang secara periodik. Sistem periodik modern dikenal juga sebagai sistem periodik bentuk panjang, terdapat lajur mendatar yang disebut periode dan lajur tegak yang disebut golongan.
Dalam sistem periodik modern terdapat 7 periode, yaitu:
Periode 1 : terdiri atas 2 unsur
Periode 2 : terdiri atas 8 unsur
Periode 3 : terdiri atas 8 unsur
Periode 4 : terdiri atas 18 unsur
Periode 5 : terdiri atas 18 unsur
Periode 6 : terdiri atas 32 unsur, yaitu 18 unsur seperti periode 4 atau 5, dan 14 unsur lagi merupakan deret lantanida
Periode 7 : merupakan periode unsur yang belum lengkap. Pada periode ini terdapat deret aktinida
6. Hubungan Konfigurasi Elektron dan Sistem Periodik Unsur
Konfigurasi elektron sangat erat hubungannya dengan sistem periodik unsur. Seperti telah Anda ketahui, bahwa sifat-sifat unsur sangat bergantung pada jumlah elektron valensinya. Jika jumlah elektron luar yang mengisi orbital dalam subkulit sama dengan bilangan kuantum utama (n), atom unsur tersebut pasti terletak pada golongan yang sama (selain yang berbentuk ion). Adapun nilai n (bilangan kuantum utama) yang terbesar menunjuk nomor periode unsur tersebut dalam sistem periodik unsur. Misal, konfigurasi elektron unsur K sebagai berikut.
19K : 1s2 2s2 2p6 3s2 3p6 4s1.
Nilai n terbesar adalah 4. Jadi, K menempati periode 4.
Untuk menentukan golongan unsur dalam sistem periodik berdasarkan konfigurasi elektron, perlu dilihat jenis dan jumlah elektron terluar yang menempati kulit yang sama.
a. Golongan utama (Gol. A), elektron valensi menempati subkulit s atau subkulit s dan p.
b. Golongan transisi (Gol. B), elektron valensi menempati subkulit s dan d.
Untuk lantanida dan aktinida, elektron valensi menempati subkulit s dan f, tetapi jumlahnya tidak menentukan golongan karena lantanida dan aktinida tidak mempunyai golongan.
7. Pembagian Unsur-Unsur menurut Blok s , p, d, dan f
Berdasarkan kesamaan konfigurasi elektron terluar, dapat dikelompokkan unsur-unsur tersebut dalam blok berikut.
a. Blok s
Unsur yang mempunyai konfigurasi elektron terluar pada orbital s terletak pada golongan IA dan IIA, kecuali unsur H dan He. Unsur-unsur ini merupakan logam yang reaktif. Misal, konfigurasi elektron terluar adalah nsx. Maka, unsur tersebut terletak pada golongan xA.
b. Blok p
Unsur yang mempunyai konfigurasi elektron terluar pada orbital p terdapat dalam golongan IIIA, IVA, VA, VIA, VIIA, dan VIII. Golongan unsur-unsur ini meliputi logam, metaloid, dan non logam. Misal, konfigurasi elektron terluar adalah npy. Maka, unsur tersebut terletak pada golongan (2 + y)A.
c. Blok d
Konfigurasi elektron terluar d terdapat dalam unsur-unsur transisi, yaitu golongan IIIB, IVB, VB, VIB, VIIB, VIIIB, IB, dan IIB.
Jika:
a. x + z = 8, x + z = 9, dan x + z = 10, unsur terletak pada golongan VIIIB
b. x + z = 11, unsur terletak pada golongan IB
c. x + z = 12, unsur terletak pada golongan IIB
d. Blok f
Blok f merupakan golongan unsur lantanida dan aktinida. Golongan ini disebut juga golongan transisi dalam.